結直腸癌是起源于結直腸上皮細胞的惡性腫瘤�,其發(fā)病率和死亡率分別居于所有惡性腫瘤的第三位和第二位[1]。早期結直腸癌治療后5年生存率可超過90%����,甚至可以完全治愈�����,晚期患者的5年生存率不足10%[2],因此��,結直腸癌的早診早治是降低發(fā)病率和死亡率的關鍵���,目前�,多種類型的結直腸癌無創(chuàng)診斷標記物正被廣泛研究�。
結直腸包括盲腸、升結腸�����、橫結腸���、降結腸����、乙狀結腸和直腸部分����。研究表明發(fā)生于不同部位的結直腸癌在流行病學�、組織學類型�、分子特征、疾病進展和預后等方面具有很大的差異�����,其原因可能是不同的發(fā)育起源或差異化的致癌因素(如細菌群落�����、營養(yǎng)供應和膽汁酸水平等的差異)[3,4]�����。本文將簡要介紹基于解剖學位置的結直腸癌的分類���、不同位置的結直腸癌的流行病學�����、癌變途徑及相關分子特征的差異�,最后強調在開發(fā)結直腸癌診斷標志物時應充分考慮位置差異。
在胚胎發(fā)育起源上��,盲腸����、闌尾、升結腸��、肝曲����、橫結腸近端三分之二起源于中腸����,而遠端三分之一橫結腸、脾曲��、乙狀結腸���、降結腸結腸和直腸起源于后腸���。左右結腸的分層理論早在1990年就由美國腫瘤專家Bufill等從分子遺傳學角度提出[5],即根據(jù)腫瘤接近或遠離結腸脾曲將結直腸癌分為近端腸癌或遠端腸癌�,之后的很多學者延用了這種劃分方法,將結直腸癌分為兩類:近端(右側)結直腸癌為位于盲腸、升結腸和橫結腸上的癌癥�;遠端(左側)結直腸癌為位于降結腸、乙狀結腸和直腸上的癌癥�����。之后也有研究者提出應該將直腸癌單獨作為一個分類[6,7]��,因為其流行和預后不同于結腸癌���,基于此���,結直腸癌有三個位置分類,即右側/近端結腸癌��、左側/遠端結腸癌和直腸癌(圖1)�。
圖1?結直腸癌的三個位置分類[7]
不同位置分類結直腸癌的流行病學����、
癌變途徑及分子特征
在流行病學方面��,早發(fā)(發(fā)病年齡<50歲)結直腸癌和家族性腺瘤性息肉?�。‵AP)患者多發(fā)生在左側/遠端結腸和直腸��;
在分子特征方面���,右側/近端結腸癌多富集高微衛(wèi)星不穩(wěn)定性(MSI-high)、高CpG島甲基化表型(CIMP-high)和BRAF突變等特征�����,左側/遠端結腸癌多富集染色質不穩(wěn)定(CIN)特征[7,8]����。
如表1所示�����,結直腸癌的兩種主要癌變途徑分別為傳統(tǒng)途徑和鋸齒狀途徑���,其癌前病變類型分別為傳統(tǒng)腺瘤和無蒂鋸齒狀病變(SSL)���。傳統(tǒng)腺瘤包括管狀腺瘤、絨毛狀腺瘤和管狀絨毛狀腺瘤,較為均勻地分布在左右結腸����;而無蒂鋸齒狀病變則主要分布在右側/近端結腸,由于其扁平或無柄的形態(tài)����,且不易出血[9],無蒂鋸齒狀病變較傳統(tǒng)腺瘤更難被腸鏡或便隱血檢測發(fā)現(xiàn)����,無蒂鋸齒狀病變的漏檢是間期癌發(fā)生的重要原因。
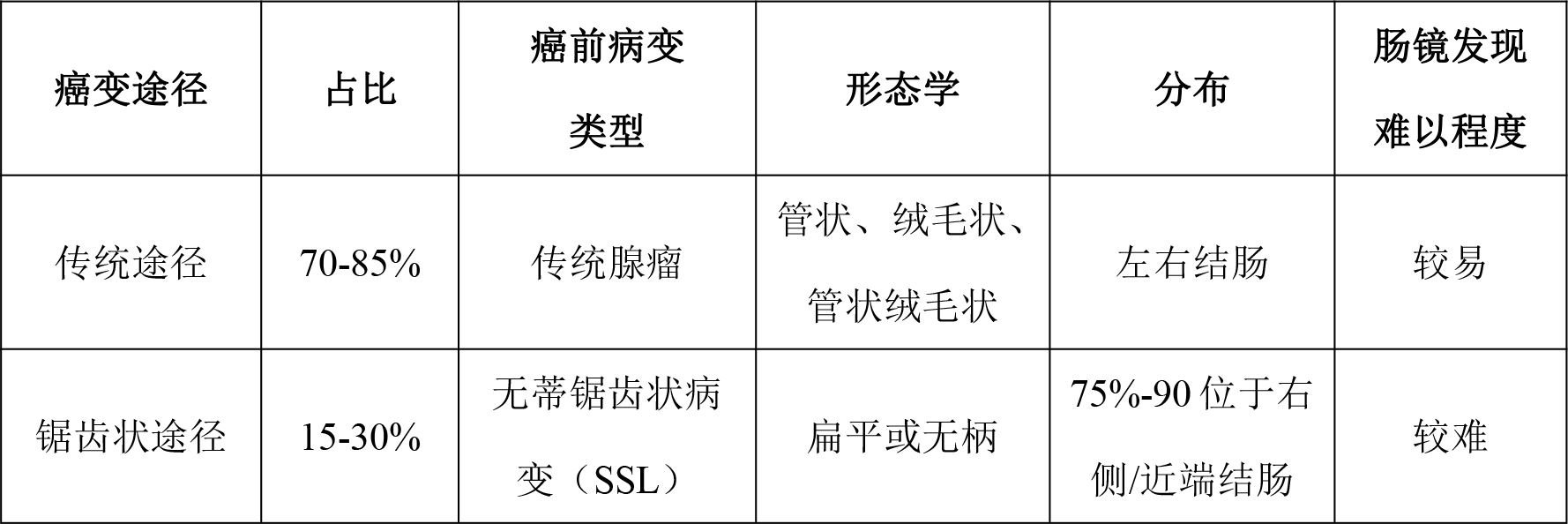
表1?結直腸癌傳統(tǒng)和鋸齒狀癌變途徑的差異
結直腸癌診斷標記物發(fā)現(xiàn)過程中的位置考慮
現(xiàn)有腸癌標記物的發(fā)現(xiàn)過程大多基于腸癌樣本����,無法考慮癌變途徑�����,例如鋸齒狀形態(tài)僅保留在通過鋸齒狀路徑產(chǎn)生的約三分之一的結直腸癌中,而其余三分之二在進展為晚期癌癥時失去鋸齒狀組織學特征[10-13]����,這些問題使得難以通過形態(tài)學(即內鏡和組織學)區(qū)分給定的結直腸癌是通過傳統(tǒng)還是鋸齒途徑發(fā)展而來的,最終可能會導致篩選到的標記物的檢測效果存在位置差異����。
以結直腸癌常見的甲基化標記物SDC2和TFPI2為例,在一項研究中[14]����,研究者分析TCGA和GEO數(shù)據(jù)庫中的結直腸癌樣本及該研究收集到的臨床組織樣本,根據(jù)SDC2和TFPI2的甲基化水平�����,將樣本分為HH組(SDC2和TFPI2均高甲基化)���、HL組(一個基因高甲基化,另一個低甲基化)和LL組(SDC2和TFPI2均低甲基化)���,分析這幾個組的樣本在腫瘤位置方面的差異(圖2)���。結果顯示HH組和LL組在右半結腸癌����、左半結腸癌和直腸癌中均有分布���,而HL組樣本則主要分布在左半結腸癌樣本中��,其中HL中TFPI2高甲基化出現(xiàn)頻率約是SDC2出現(xiàn)高甲基化頻率的三倍����,表明SDC2低甲基化主要發(fā)生在左半結腸癌中����,而TFPI2在SDC2低甲基化樣本中仍能保持高甲基化,進一步提示了SDC2對左半結腸癌的檢出率可能不如右半結腸癌���,而TFPI2的加入可能會彌補SDC2的漏檢�����。
圖2 HH�、LL和HL三種基因型結直腸癌的位置分布
在另外兩項研究中[15,16],研究者分別進行了多中心(圖3和圖4)的組織樣本和/或糞便樣本研究����,結果均顯示SDC2和TFPI2甲基化聯(lián)合檢測能提升對結直腸癌和腺瘤的檢測敏感性,且敏感性的提升在左半結腸更為明顯���。
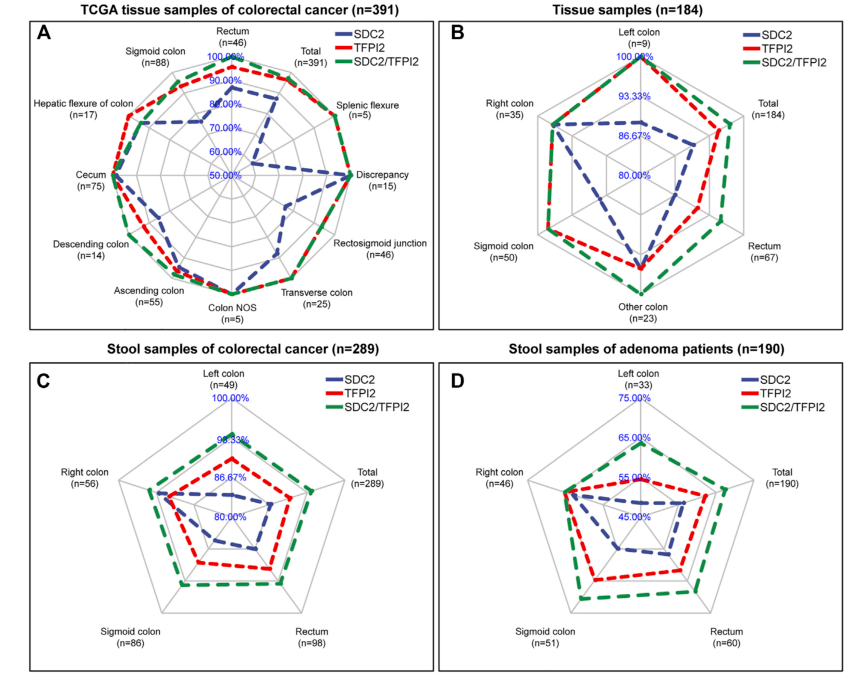
圖3?SDC2和TFPI2聯(lián)合檢測互補效應與位置關系雷達圖
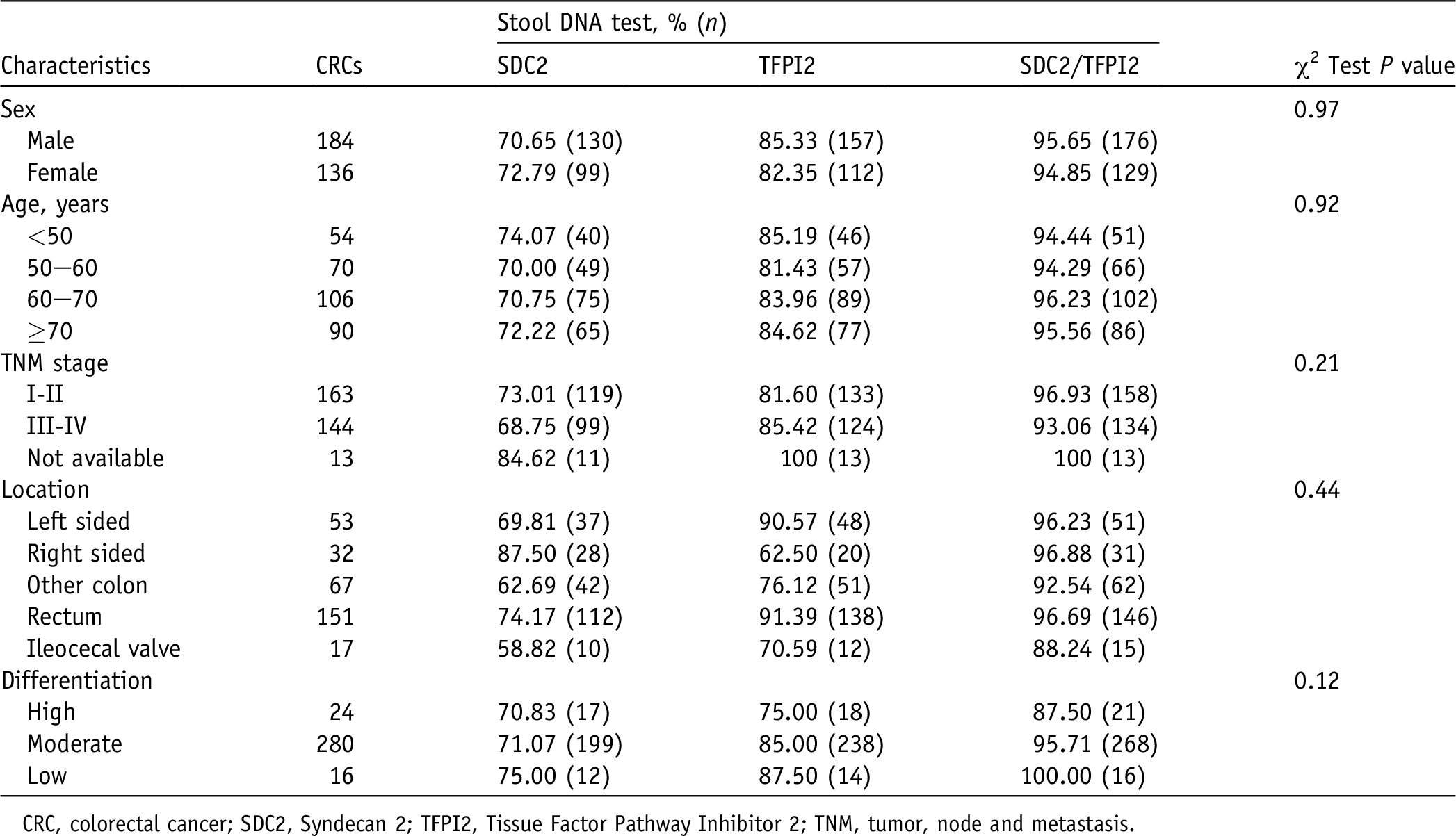
圖4?SDC2和TFPI2甲基化在不同部位的結直腸癌中的檢測敏感性分析
由前述可知�,不同位置的結直腸癌對應著分子特征和癌變途徑的差異����,因此�,在結直腸癌診斷標記物發(fā)現(xiàn)過程中應充分考慮這種位置差異�,以便發(fā)現(xiàn)“一網(wǎng)打盡”式的全腸道結直腸癌檢測標記物/標記物組合�。
1.Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
2.Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics, 2020. CA Cancer J Clin. 2020;70(3):145-164.
3.?Benedix F, Kube R, Meyer F, et al. Colon/Rectum Carcinomas (Primary Tumor) Study Group. Comparison of 17,641 patients with right- and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival. Dis Colon Rectum. 2010;53(1):57-64.
4.Glebov OK, Rodriguez LM, Nakahara K, et al. Distinguishing right from left colon by the pattern of gene expression. Cancer Epidemiol Biomarkers Prev. 2003?;12(8):755-62.
5.Bufill JA. Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location. Ann Intern Med. 1990; 113(10):779-88.
6.Li FY, Lai MD. Colorectal cancer, one entity or three. J Zhejiang Univ Sci B. 2009;10(3):219-29.
7.Keum N, Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 2019;16(12):713-732.
8.Baran B, Mert Ozupek N, Yerli Tetik N,?et al. Difference Between Left-Sided and Right-Sided Colorectal Cancer: A Focused Review of Literature. Gastroenterology Res. 2018 ;11(4):264-273.
9.?Benedix F, Kube R, Meyer F, et al. Colon/Rectum Carcinomas (Primary Tumor) Study Group. Comparison of 17,641 patients with right- and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival. Dis Colon Rectum. 2010;53(1):57-64.
10.Bettington M, Walker N, Clouston A, et al. The serrated pathway to colorectal carcinoma: current concepts and challenges. Histopathology. 2013 Feb;62(3):367-86.
11.García-Solano J, Pérez-Guillermo M, Conesa-Zamora P, et al. Clinicopathologic study of 85 colorectal serrated adenocarcinomas: further insights into the full recognition of a new subset of colorectal carcinoma. Hum Pathol. 2010 Oct;41(10):1359-68.
12.M?kinen MJ, George SM, Jernvall P, et al. Colorectal carcinoma associated with serrated adenoma--prevalence, histological features, and prognosis. J Pathol. 2001 Mar;193(3):286-94.
13.Tuppurainen K, M?kinen JM, Junttila O, et al. Morphology and microsatellite instability in sporadic serrated and non-serrated colorectal cancer. J Pathol. 2005 Nov;207(3):285-94.
14.Lei R, Zhao Y, Huang K, et al. The methylation of SDC2 and TFPI2 defined three methylator phenotypes of colorectal cancer. BMC Gastroenterol. 2022;22(1):88.
15.Zhang L, Dong L, Lu C, et al. Methylation of SDC2/TFPI2 and Its Diagnostic Value in Colorectal Tumorous Lesions. Front Mol Biosci. 2021;8:706754.
16.Wang Z, Shang J, Zhang G, et al. Evaluating the Clinical Performance of a Dual-Target Stool DNA Test for Colorectal Cancer Detection. J Mol Diagn. 2022;24(2):131-143.